酵母菌在处理高浓度有机废水时具有一定的优势,如处理负荷高、需氧量低、可降解油和脂肪以及可回收单细胞蛋白等,但系统运行的稳定性问题一直限制着该技术的工程化应用. SRT是活性污泥法处理废水中一个重要参数,影响着系统中的污泥浓度、污泥产率、污泥沉降性、微生物群落结构以及胞外聚合物 (EPS) 的组成及含量等. EPS是活性污泥絮体中促使微生物凝聚的关键物质,是影响活性污泥絮凝沉降性能及表面性质的重要因素.目前关于活性污泥中EPS与污泥沉降性的研究表明,EPS总量与污泥絮凝性存在正相关性.但对于酵母菌废水处理系统而言,主体微生物是酵母菌群,有别于以细菌为主体的活性污泥.迄今为止,尚未见有关SRT对酵母菌在废水处理系统中产EPS及EPS对酵母沉降性的影响的报道.本研究在小型SBR反应器中考察不同SRT对酵母菌产EPS、EPS组成以及EPS对酵母沉降性的影响,并利用PCR-DGGE及克隆测序解析了长、短SRT下的酵母群落结构,试图探明SRT对酵母菌处理油脂废水稳定性的影响,以期为建立高效稳定的酵母废水处理系统奠定基础.
1 材料及方法1.1 实验材料
本研究使用3株酵母菌:分别是O2(Candida tropidalis)、G1(Candida lipolytica)、W1(Candida halophila).菌株活化方法参见文献.
油脂废水取自宁波市某油脂生产企业的碱炼车间,废水COD在20 000 mg ·L-1左右.将所取废水根据实验所需进行稀释,稀释后的废水水质为:COD 6 500~8 500mg ·L-1;TN 3.4~5.8 mg ·L-1;TP 32.4~45.4 mg ·L-1;BOD5 1 950~3 200mg ·L-1;油1 817~2 258 mg ·L-1;pH 6.5~8.8.
1.2 实验装置以及运行条件
实验在4个有效容积为2 L的小型SBR反应器中进行,由程序控制器控制周期性运行.废水稀释后,根据废水的BOD5添加 (NH4)2SO4、KH2PO4使BOD5 :N :P为100 :5 :1.一个运行周期为曝气9 h,静置沉降3 h,排水比为1/2.静置期间更换新配制的废水,同时将混合液pH调整至5.0~5.5,温度控制在28℃左右,溶解氧维持在0.5~1.5mg ·L-1.
1.3 实验方法
将活化的复合酵母培养物投入到一个有效体积为10 L的有机玻璃容器内,加入COD为3 000~4 000 mg ·L-1的含油废水,添加氮源、磷源使废水BOD :N :P为100 :5 :1,同时调节废水的pH至5.0~5.5,进行曝气培养.培养4 d后将废水COD逐渐提升至7500mg ·L-1左右,待系统的MLSS增长至5.3 g ·L-1,转移酵母至小型SBR反应器中.本实验酵母的MLVSS/MLSS为90.93%,接种MLSS为4.5 g ·L-1.本实验采用每天定时定量排泥的方式控制SRT,各反应器的SRT依次设计为5、10、20、40 d.为保证反应器基本进入稳态运行,每个SBR基本运行两倍以上的SRT时间 (除了SRT=40 d的系统,后期出现了SVI急剧上升).
1.4 分析方法
COD:采用快速消解仪DRB200及DR1010 COD (美国HACH) 分析仪测定,处理后出水经过5 000 r ·min-1,5 min离心后取上清液测定COD;油含量:采用四氯化碳萃取法,使用OIL480红外测油仪 (北京华夏科创) 测定;BOD5采用BOD Trak (美国HACH) 测定;pH: HM-30P便携式pH仪 (日本DKK-TOA);MLSS及MLVSS采用国家标准方法测定.
本实验中,紧密黏附胞外聚合物 (TBEPS) 中蛋白质和多糖含量视为TBEPS总量;松散附着胞外聚合物 (LBEPS) 中2种组分之和视为LBEPS总量. LBEPS提取方法:分别取一定体积的污泥混合液,8 000 r ·min-1离心10 min,去上清液.将上述污泥沉淀重新悬浮于0.9%NaCl溶液中,放置于超声分离器中,超声分离5 min, 然后在12 000 r ·min-1离心15 min, 上清液即为LBEPS,收集上清液测定其中多糖及蛋白质含量. TBEPS提取方法[14]:将提取LBEPS后的污泥重新悬浮,然后在80℃下水浴提取30 min, 在12 000 r ·min-1离心15 min,获得的上清液即为TBEPS,收集上清液测定其中多糖及蛋白质含量.多糖含量采用苯酚-硫酸法测定,蛋白质含量采用考马斯亮蓝法测定.
1.5 系统中酵母群落结构分析1.5.1 DNA提取
取各SBR中混合液1.5 mL于2 mL的离心管中,8 000 r ·min-1下离心2min,弃上清,使用FastDNA SPIN Kit for Soil试剂盒 (美国Mpbio) 提取生物样的DNA.提取的DNA存放于-20℃冰箱保存.
1.5.2 PCR-DGGE
PCR扩增:上游引物GC1-NL1(5′-GCATAT CAA TAAGCG GAG GAA AAG-3′) 和下游引物LS2(5′-ATT CCC AAA CAA CTC GAC TC-3′).引物由上海生工生物技术有限公司合成. 50 μL PCR反应体系包含:1 μL模板DNA,1 μL引物 (正向和反向引物各0.5 μL),23 μL RNA Freewater, 25 μL Premix (Takara Taq Version 2.0 plus dye).
PCR反应条件:预变性条件为95℃ 5 min;30个循环为变性95℃ 60 s退火52℃ 45 s,延伸72℃ 60 s;最后在72℃下延伸7 min. PCR扩增产物用1.0%琼脂糖凝胶电泳检测.
DGGE电泳:在变性梯度凝胶电泳仪 (Bio-Rad) 上进行.丙烯酰胺凝胶浓度为8%,变性剂梯度为30%~50%.向PCR扩增的50 μL体系中加入6×loading buffer 10 μL,充分混合后点样35 μL.电泳条件:60℃、120 V下运行6~8 h,电泳完毕后,将凝胶在含0.01% SYBR (Biotium) 的高纯水中染色20 min,取出后用去离子水清洗2次,每次5 min,最后置于Gel DocXR (Bio-Rad, USA) 凝胶成像系统拍照.
mvr蒸发器厂家:www.gdgrsw.com
1.5.3 16S rRNA克隆和测序
对DGGE凝胶中出现的新的条带进行切胶回收及纯化,纯化后的样品再用PMD19-T (Takara) 载体进行连接 (16℃连接16h),然后取-80℃保存的感受态细胞Escherichia coli DH5α(Takara) 迅速融合并置于冰上,加入10 μL连接液,轻轻摇匀置于42℃水浴锅静置90 s,然后转入冰浴1~2 min后加入新鲜LB培养基890 μL,放置在预设为37℃的恒温振荡器中170r ·min-1处理1 h.然后涂布到含有氨苄青霉素/IPTG/X-Gal的LB培养基平板上,37℃下培养16 h,并设置对照.随机选取一定数量的白色阳性克隆子,经液体培养后送至上海英骏公司进行序列测定.将测定的目的基因片段序列与GenBank中已知序列进行比对 (http://www.ncbi.nlm.nih.gov/BLAST/).
2 结果与讨论2.1 SRT对COD和油去除率的影响
不同SRT下酵母菌对COD和油的去除效果如图 1所示.从中可以看出,在运行初期,SRT为20 d的系统对COD和油的去除率均较高,第5 d后SRT为5 d的系统对COD和油的去除效果最好,而SRT为10 d和20 d的效果较接近.可能的原因是,将扩大培养好的酵母细胞投入到不同SRT的系统中时,细胞需要经过适应新F/M的调整期,而SRT为20 d的系统是最接近原培养系统SRT的,所以适应期短;而SRT=5 d的系统由于周期排泥量最大,因而对系统中酵母生物量冲击较大,所以运行初期处理效果较差,而随后酵母细胞适应此排泥周期,且该SRT条件下酵母新陈代谢快,所以处理效果逐渐变为最好.对SRT为40 d的系统,运行到30 d后处理效果逐渐变为最差,这是由于对于SRT为40 d的系统排泥量少,老龄化酵母细胞多,代谢活力低.就不同SRT对油去除率的影响来看,除了SRT为40 d的系统以外,其他SRT下油的去除率差异不大.

图 1 SRT对COD和油去除率的影响
2.2 SRT对EPS的组成及含量的影响
EPS是活性污泥絮体中继水分和细胞后的第三大组成部分,主要是细菌细胞新陈代谢分泌的高分子聚合物聚集在细胞外部,形成絮凝胶体物质,同时还含有废水中的某些物质,即污泥所处的基质环境. Ravella等研究表明酵母菌也能产生EPS. TBEPS位于里层,与细胞表面结合较紧,稳定地附着于细胞壁外,具有一定外形;LBEPS位于TBEPS外层,具有较松散的结构,是可向周围环境扩展、无明显边缘的黏液层. EPS的主要成分是糖类和蛋白质,两者的总有机碳占整个EPS的70%~80%.有研究表明,SRT不仅影响着EPS的总量,还影响其组成成分及比例.
不同SRT条件下酵母系统中LBEPS的组成和含量的变化如图 2所示,可以看出,对于酵母菌来说,LBEPS的主要成分是多糖,蛋白质含量很少,且EPS总量随SRT的增大而减少.根据劳伦斯-麦卡蒂方程及其衍生关系式1/θC=Y×Nrs-Kd可知SRT与负荷呈负相关. Batstone等、李久义等认为EPS与污泥负荷呈正比 (即与SRT呈反比),所以在低SRT情况下F/M较高,微生物细胞不能将所有碳源用于细胞合成,多余的含碳基质可以转化成胞内存储粒子和在EPS中积累的胞外高分子.从图 2可看出,对SRT为5 d、10 d的系统,在开始的4~5 d内,LBEPS呈递增的趋势,这可能是由于酵母系统对新环境的一种适应过程,为了适应较短的SRT,酵母细胞新陈代谢比较旺盛,所以将油脂废水中脂肪酸转化为多糖的量也增多,导致多糖积累,待系统稳定后,LBEPS也基本稳定.对于SRT为40 d的系统,从30 d后有大幅度的降低,这是由于随着运行的持续,酵母产乳化剂能力相对于酵母增长能力减弱,表现为油脂降解能力下降[见图 1(b)],同时酵母细胞的菌丝化也影响了油脂的代谢,此时酵母细胞为维持自身生理代谢,可能对EPS中的多糖类物质进行降解.
利用Matlab数据分析软件将SRT为5、10、20、40 d作为因素X1, 不同时间段测得的LBEPS为X2进行差异性分析,得α=0.000(α < 0.01),即不同SRT条件下LBEPS含量具有显著性差异,说明SRT对酵母处理油脂废水LBEPS的产生影响显著.
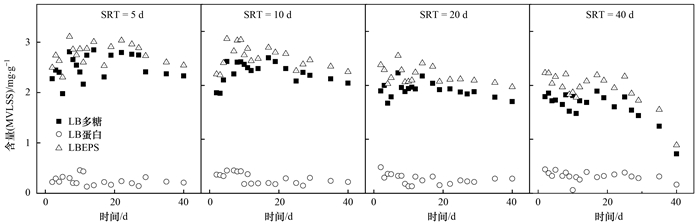
图 2 SRT对LBEPS的组成和含量影响
图 3反映了各系统中TBEPS的变化.可以看出TBEPS仍然以多糖为主,结合图 2,TBEPS的含量远远大于LBEPS,大约是后者10倍左右,这与一些研究的结果一致. TBEPS的组成及含量变化与LBEPS相同,含量随着SRT的增大而减少.对于SRT为5、10、20 d的系统在最初5 d内TBEPS有所增加,这是酵母对新环境的一种适应,随后逐渐稳定.对于SRT为40 d的系统,随着时间的延长,酵母细胞老龄化及代谢产物的积累,酵母细胞有丝化现象,丝化后酵母细胞对油脂类代谢能力减弱,进而转为利用和代谢TB多糖,导致在20 d后TBEPS逐渐减少.

图 3 v
同样以SRT为5、10、20、40 d作为因素X1,不同时间段测得的LBEPS为X2进行差异性分析,得α=0.00(α < 0.05),可以认为不同SRT条件下测得的TBEPS具有显著性差异,说明SRT对酵母处理油脂废水TBEPS的产生也有显著影响.
2.3 SRT对酵母污泥SVI的影响
对不同SRT下4个系统的SVI进行了连续监测,结果如图 4所示.从中可以看出, 在前20 d运行中SVI基本稳定,SVI值随SRT的延长而增大,说明增大SRT会引起SVI值升高,与陶丽佳等的研究结论相同.但从18 d后,直至30 d间污泥的SVI值随SRT延长反而减小,可见其规律有别于普通活性污泥,这可能与酵母细胞菌丝化有关.在这个阶段,各SRT系统中酵母细胞均有不同程度丝化现象,由丝化导致了污泥质量浓度 (MLSS) 减小,所以总体SVI较运行前期要大;此时,各系统酵母污泥的SV30差异减小,而SRT越长对应系统中的MLSS越大,因而出现了SVI值随SRT的增长而降低的现象.运行至30 d后,对SRT为40 d的系统,SVI值呈直线上升,一方面是由于较长的SRT条件下,EPS的浓度相对较低 (见图 2和图 3),不利于酵母细胞絮凝;另一方面酵母细胞由酵母型向菌丝态转化导致污泥呈蓬松状态,难以沉降,周期性排泥导致更低的MLSS. SRT为20 d的系统中SVI的变化与前者相似,但变化幅度稍微缓慢,推测与细胞不同的丝化程度有关.图 5为不同SRT下各系统在运行后期的显微镜图片.比较可以看出,在SRT为5 d时系统中酵母絮体中菌丝很少;SRT为10、20、40 d时菌丝化程度递增,在SRT为40 d时可以观察到明显的细胞丝化现象.通过Matlab对SRT和SVI因素进行差异性分析,得α=0.45,可以认为不同SRT条件下测得的SVI不具有显著性差异,说明在当前区间内SRT对酵母处理油脂废水SVI的影响不显著.因此,不同SRT对酵母系统的影响,可能更多地体现在SRT对酵母细胞菌丝化程度的影响,低SRT更有利于细胞丝化的控制.
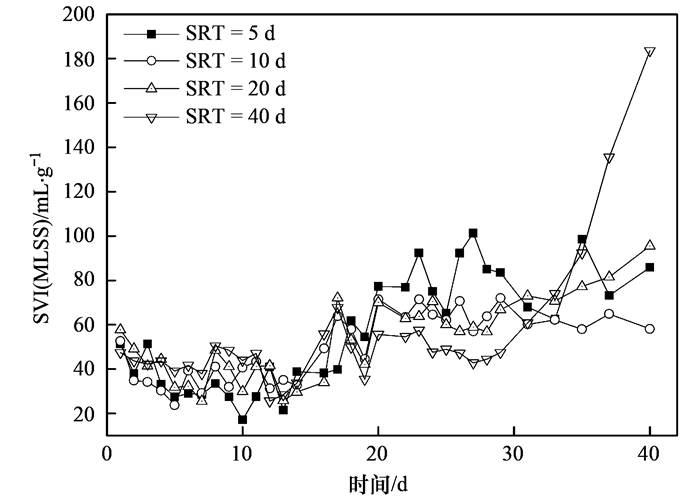
图 4 不同SRT下各SBR中污泥SVI的变化
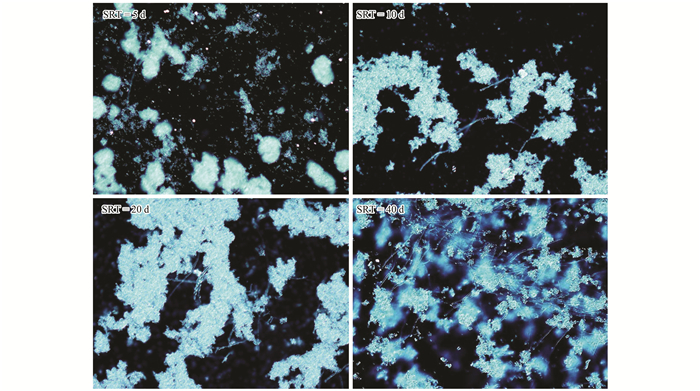
图 5 各SRT运行后期酵母污泥镜检图片
2.4 系统中酵母群落结构解析
选取SRT为5 d和SRT为40 d系统,运行后期对其生物样品进行PCR-DGGE分析,结果如图 6.对比两个系统的DGGE图谱可以看出,初始添加的3株酵母O2、G1、W1在各系统中一直存在,前期研究也表明这3株酵母菌可以稳定存在于酵母菌处理含油废水系统中.随着系统的运行,大约在22 d后,3株菌株的条带有所减弱,说明对应酵母细胞的浓度有所降低.但与此同时,在系统运行的第10 d,长和短SRT下均出现了另外3个条带 (分别命名为1、2、3),特别对于SRT为40 d的系统,3个条带亮度在运行后期有所加强,说明对应微生物的丰度增强.通过对这些新增条带的切胶、克隆和测序并与GenBank中序列比对,初步判定新增的酵母分别是:1. Candida cylindracea(相似度100%);2. Candida intermedia(相似度99%);3. Yarrowia lipolytica(相似度99%),结果见表 1.通过查阅已有研究发现,这3株酵母均可以利用或者水解橄榄油等油脂,均可以产生脂肪酶,因此3株菌株的出现是系统运行过程中自然选择的一个结果,菌株可能来源于废水.对于SRT为40 d的系统出现的明显的真菌丝,目前尚不能判定是系统中原有的酵母还是外源性酵母发生菌丝化而形成,但可以肯定的是,无论是哪种酵母细胞发生菌丝化,短SRT比长SRT更能抑制细胞的丝化程度,从而更有利于系统运行的稳定.相关研究结果表明,白假丝酵母 (Candida albicans) 的细胞在一定的物质条件刺激下可能发生细胞形态转化.对于长SRT的系统,污泥浓度高,老龄细胞比例大,产生的代谢产物容易在系统中积累,这可能是诱导某些酵母细胞丝化的原因,具体情况还需要进一步的研究.
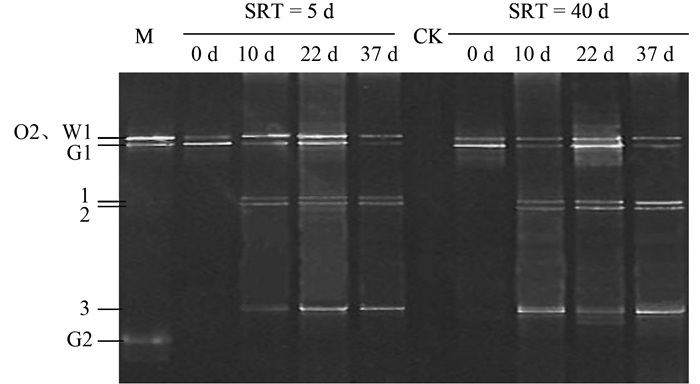
图 6 不同SRT下系统中酵母群落的DGGE图谱

表 1 系统中外源性酵母16S rRNA基因序列比对结果
3 结论
(1) SRT为5~10 d时系统对油脂废水COD和油的去除率较高;长SRT会使COD处理效果下降,但短期对油的去除率影响不大.
(2) 酵母污泥的EPS中以TBEPS为主,EPS的主要成分为多糖,蛋白质的含量较少;长SRT会导致EPS含量降低及酵母污泥的SVI升高.
(3) SRT在5~40 d区间内,SRT对酵母污泥的SVI影响差异不显著;但长SRT有导致系统发生丝状菌性膨胀的风险.
(4) 长期连续运行后系统中均出现了可以利用或降解油脂的外源性酵母菌株. |
