1 引言(Introduction)
Cu、Zn、Mn对于植物和人体都是必需元素, 参与植物和人体的部分代谢活动, 但过量对植物和人体均会造成危害.如当土壤中Cu的含量达到50 μg·g-1时, 柑橘幼苗生长就会受到抑制, 含量达到200 μg·g-1时, 小麦会枯死, 含量达到250 μg·g-1时, 水稻就会死亡(戴树桂, 2006);过量的铜会引起人体溶血、肝胆损害等疾病, 过量的Zn进入人体会引发贫血、高血压、冠心病等疾病, 而过量的Mn则会引起人体呼吸困难、意识模糊、咳嗽、头痛等症状.由此可见, 尽管Cu、Zn、Mn对环境及人体的危害程度不及Pb、Cd等需要优先控制重金属元素, 但它们对环境所造成的污染仍不容忽视. Cu、Zn、Mn污染环境和危害人体健康的重要途径之一就是通过水体, 因此, 进行水体Cu、Zn、Mn污染的治理研究有十分重要的现实意义.
在众多的水体重金属污染治理方法中, 吸附法已被越来越多的研究证明为一种行之有效、经济实用的方法(马锋锋等, 2017;杨林等, 2016;刘娟娟等, 2014;胡田田等, 2012;Fu et al., 2015;Ozturk and Sahan, 2015;Song et al., 2015;Sun et al., 2014;Zhu et al., 2014;Al-Ghouti and Al-Degs, 2011).吸附法的应用关键在于吸附剂的选择.硅藻土作为一种多孔性天然矿物, 具备大量的微孔与活性基团, 同时具有一定的负电性, 是良好的吸附材料, 被广泛用于处理含重金属离子废水.近年来, 国内外研究人员对硅藻土吸附重金属离子开展了大量研究. Beheshti和Irani(2016)研究了硅藻土纳米颗粒对Pb2+的吸附, 结果表明, 在溶液温度为45 ℃, 吸附时间为90 min的条件下, 硅藻土纳米颗粒对Pb2+的最大吸附量可达103.1 mg·g-1, 同时研究发现, 硅藻土纳米颗粒对Pb2+的吸附符合一级动力学模型和Langmuir等温吸附模型, 吸附过程是吸热的、自发的. Liu等(2013)采用碳酸钙对低品位硅藻土进行了改性, 并将改性后的硅藻土用于吸附水体中的Cu2+、Pb2+、Zn2+和Cd2+, 结果表明, 当溶液温度为15 ℃, 离子初始浓度为1.5 mmol·L-1, 投加量为10 g·L-1, 吸附时间为60 min条件下, 改性硅藻土对上述重金属离子具有最佳的吸附效果. Yuan等(2013)研究表明, 表面硅烷化能有效改善硅藻土对Cu2+的吸附性能. Li和Zeng(2012)采用微乳液对硅藻土进行了改性, 并将改性后的硅藻土用于吸附Pb2+、Cu2+和Cr3+, 结果表明, 微乳液改性能明显改善硅藻土的表面性能, 提升硅藻土的吸附能力. Safa等(2012)研究表明阿尔及利亚天然硅藻土对Cu2+、Zn2+、Cd2+和Pb2+最大吸附量分别为0.319、0.311、0.180和0.096 mmol·g-1, 吸附过程符合二级动力学模型, Langmuir和Freundlich等温模型均可以很好地描述其平衡吸附过程, 吸附是容易的、自发的.由此可见, 关于硅藻土对Cu2+、Zn2+、Mn2+吸附特性的研究多数止步于对吸附影响因素的研究和对等温吸附及吸附动力学的简单探讨, 未对吸附过程特性进行深入探究.鉴于此, 本研究采用静态吸附试验对硅藻土吸附Cu2+、Zn2+、Mn2+的过程特性进行了深入、全面的研究, 研究结果可为硅藻土在含重金属离子废水处理上的应用及其它类似研究提供理论依据和借鉴.
2 材料与方法(Materials and methods)2.1 试验材料
硅藻土购自浙江嵊州, 使用前用超纯水反复擦洗, 去除硅藻土壳体表面杂质, 之后置于烘箱内于105 ℃烘干, 研磨, 过100目土壤筛, 取筛下土置于干燥器中备用.硅藻土的孔隙结构见图 1, 基本理化性质见表 1.

图 1硅藻土SEM照片
表 1 硅藻土基本理化性质

含Cu2+、Zn2+、Mn2+标准溶液分别由分析纯Cu(NO3)2·3H2O、Zn(NO3)2·6H2O、MnSO4·H2O配制.准确称取3.8020 g Cu(NO3)2·3H2O、4.5495 g Zn(NO3)2·6H2O、3.0750 g MnSO4·H2O分别溶于超纯水中, 定容至1000 mL, 制得1000 mg·L-1的含Cu2+、Zn2+、Mn2+储备液, 保存待用.
2.2 试验方法2.2.1 平衡吸附试验
取100 mL设定浓度含Cu2+、Zn2+、Mn2+标准溶液置于250 mL具塞锥形瓶中, 调节pH至一定值, 加入一定量供试硅藻土, 于150 r·min-1转速下恒温振荡, 直至吸附达到平衡, 用中速定性滤纸分离硅藻土与水样, 采用原子吸收分光光度法测定水样中Cu2+、Zn2+、Mn2+浓度, 计算吸附量.每个处理设3个平行样, 取均值进行数据分析.
2.2.2 等温吸附试验
取100 mL系列初始浓度含Cu2+、Zn2+、Mn2+标准溶液于250 mL具塞锥形瓶中, 调pH值至5.0左右, 投加一定量供试硅藻土, 分别于25、40、55 ℃下恒温振荡2 h, 直至吸附平衡, 然后分离水样, 测定Cu2+、Zn2+、Mn2+平衡浓度Ce, 计算平衡吸附量qe, 做出qe-Ce的关系曲线, 对曲线采用Freundlich、Langmuir、Temkin、D-R等温吸附模型进行拟合, 根据拟合结果分析吸附过程相关属性.
2.2.3 吸附动力学试验
取100 mL一定浓度含Cu2+、Zn2+、Mn2+标准溶液于250 mL具塞锥形瓶中, 加入一定量供试硅藻土, 调节pH值至5.0左右, 室温下恒温振荡, 直至吸附平衡, 按照设定时间点取样分离, 测定Cu2+、Zn2+、Mn2+浓度, 计算t时刻吸附量q, 做出q-t的关系曲线, 对曲线采用一级动力学、二级动力学、Elovich、双常数4种吸附动力学模型进行拟合, 根据拟合结果确定硅藻土吸附Cu2+、Zn2+、Mn2+动力学属性.
2.2.4 重金属离子测定
用Cu2+、Zn2+、Mn2+标准溶液配置一系列标样, 且待测元素的浓度应落在标准系列范围内.用北京东西仪器分析有限公司AA-7002型火焰原子吸收分光光度仪测定相应的吸光度, 绘制标准曲线, 然后测定待测样品吸光度, 消除空白, 对照标准曲线求得待测样品中重金属离子浓度.
2.3 数据处理
平衡吸附试验中所涉及到的重金属离子吸附量计算公式见式(1).
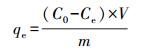
(1)
式中, C0为起始点液相重金属离子浓度(mg·L-1);Ce为平衡点液相重金属离子浓度(mg·L-1);qe为硅藻土平衡吸附量(mg·g-1);V为吸附溶液体积(mL);m为硅藻土投加量(g).
3 结果与讨论(Results and discussion)3.1 硅藻土对Cu2+、Zn2+、Mn2+吸附过程影响因素3.1.1 硅藻土投加量(W0)的影响
在自然pH值, 溶液温度为30 ℃, 离子初始浓度为200 mg·L-1的条件下, 恒温振荡2 h, 进行投加量对硅藻土吸附Cu2+、Zn2+、Mn2+的影响研究, 结果见图 2.由图 2可知, 随着投加量的增加, 供试硅藻土对Cu2+、Zn2+、Mn2+的吸附量先缓慢上升而后迅速下降, 投加量分别为8、2、2 g·L-1时达到峰值3.69、23.50、5.08 mg·g-1.液/固体系中, 吸附剂(硅藻土)浓度与吸附质(Cu2+、Zn2+、Mn2+)浓度是一对相互影响的因素.以往的研究表明(杨志军等, 2007;沈岩柏等, 2003), 硅藻土吸附Cu2+、Zn2+、Mn2+等离子的量随投加量的增加而不断减小.理论依据是, 随着投加量的增加, 硅藻土可以为离子提供更大的吸附空间、更多的活性基团与可交换离子、更强的负电性表面, 而溶液中的离子却相对恒定, 因此单位质量或面积的硅藻土吸附离子的量就会持续减少.而本研究却发现了与以往研究不一致的现象:恒定离子初始浓度, 当硅藻土投加量较低时(吸附Cu2+时为1~8 g·L-1, 吸附Zn2+、Mn2+为1~2 g·L-1), 硅藻土对Cu2+、Zn2+、Mn2+的吸附量随着投加量的增加先有所增大, 达到一峰值后迅速减小, 其中硅藻土对Cu2+的吸附表现最为明显.
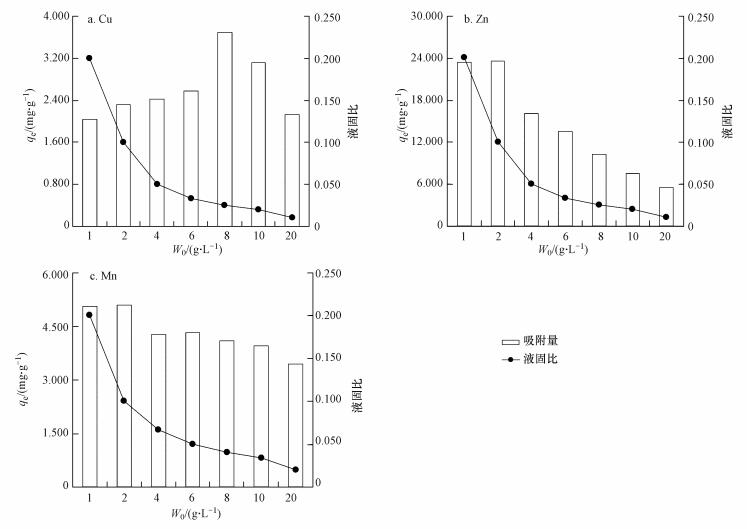
图 2硅藻土投加量的影响
投加量对硅藻土吸附Cu2+、Zn2+、Mn2+的影响与吸附体系液/固比(液相离子Cu2+、Zn2+、Mn2+与硅藻土之间质量比)有关.当液/固比较大时(硅藻土投加量较小时), 离子相对过剩, 在硅藻土壳体表面呈现堆积状态, 只有少量离子有机会与硅藻土壳体表面接触并发生吸附反应, 其它离子因同种离子间的斥力而无法靠近硅藻土壳体, 结果表现为硅藻土对Cu2+、Zn2+、Mn2+吸附量较小;随着硅藻土投加量的增大, 液/固比逐渐减小, 直至达到最适液/固比(Cu2+为0.025, Zn2+为0.100, Mn2+为0.100), 此时, 硅藻土所提供吸附点位数量与离子数量基本一致, 离子在硅藻土壳体表面得到均匀分布而被充分吸附, 硅藻土壳体表面吸附点位得到了最有效的利用, 硅藻土对Cu2+、Zn2+、Mn2+的吸附量达到了最大值;继续增大投加量, 液/固比进一步减小, 硅藻土颗粒达到一定数量后会发生团聚, 无法在液相中均匀分散, 同时硅藻土壳体所提供的吸附点位也相对过剩, 产生很多无效吸附点位, 导致吸附量不断下降.硅藻土对Cu2+吸附所需最佳液/固比与Zn2+、Mn2+相比较小, 原因在于Cu2+的水合离子半径较大.
3.1.2 离子初始浓度(C0)的影响
在自然pH值, 溶液温度为30 ℃, 一定投加量的条件下, 恒温振荡2 h, 进行离子初始浓度对硅藻土吸附Cu2+、Zn2+、Mn2+的影响研究, 结果如图 3所示.由图 3可知, 随着C0的逐步升高, 硅藻土对Cu2+、Zn2+、Mn2+的吸附量持续上升, 当C0超过一定水平时, 吸附量会明显下降.硅藻土对Cu2+、Zn2+、Mn2+的吸附量分别于C0为200、400、300 mg·L-1时达到最大值3.56、6.23、3.82 mg·g-1.

图 3离子初始浓度的影响
由图 3可知, 当C0较低时, qe与C0之间基本呈线性相关, qe随C0呈线性增大;当C0持续提高, qe-C0曲线逐渐发生弯曲, qe出现峰值后便逐渐下降, 硅藻土的投加量与离子的初始浓度对于硅藻土吸附Cu2+、Zn2+、Mn2+来说是一对互作因素, 故较高C0时与较低W0时所产生的吸附现象一致, 研究结果也充分验证了这一现象.当C0较高时, 增加C0不能促进吸附, 这与投加较少硅藻土时的现象一致.通过离子初始浓度的影响试验得到的硅藻土吸附Cu2+、Zn2+、Mn2+所需最佳液/固比分别是0.025、0.100和0.100, 与投加量的影响试验得到的结果一致, 进一步说明投加量和离子初始浓度对硅藻土吸附Cu2+、Zn2+、Mn2+的影响均可归结为液/固比的影响, 过高或过低的液固比都不利于吸附的进行.
3.1.3 溶液初始pH值的影响
在溶液温度为30 ℃, 离子初始浓度为200 mg·L-1, 一定投加量的条件下, 恒温振荡2 h, 进行溶液初始pH值对硅藻土吸附Cu2+、Zn2+、Mn2+的影响, 结果见图 4.
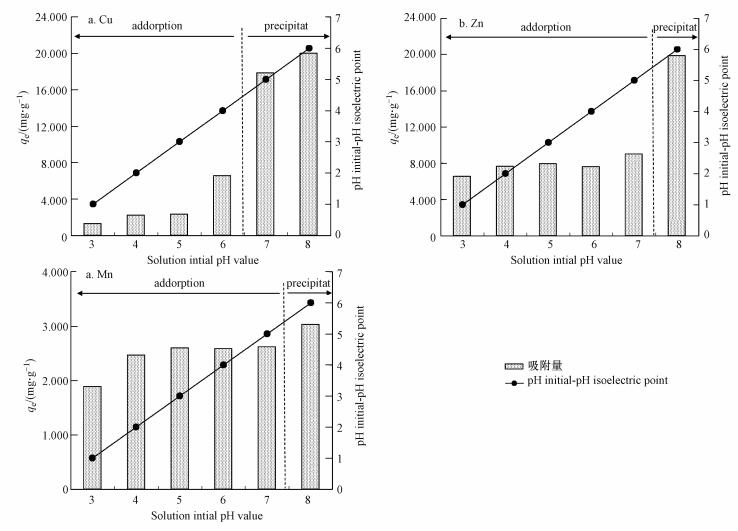
图 4溶液初始pH值的影响
由图 4可知, 酸性条件(pH值小于4.0) 不利于吸附进行, 硅藻土吸附量均较低, pH为3.0时, 供试硅藻土对各离子的吸附量分别只有1.28、6.55、1.89 mg·g-1;弱酸性或中性(pH范围为4.0~6.0) 有利于吸附的进行, 硅藻土吸附量明显提高, 当pH值为6.0时, 供试硅藻土对各离子的吸附量分别达到6.56、7.60、2.59 mg·g-1;当pH>6.0, 溶液呈碱性, 虽然硅藻土吸附量表面上有极大提升, 但提升的这部分吸附量主要是由Cu2+、Zn2+、Mn2+与OH-结合生成沉淀而产生的.
硅藻土壳体表面及微孔中所携羟基(≡Si—O—H)在液相中能解离出H+而使表面带有负电荷, 这促使硅藻土在液相中形成的胶体具备双电层.胶体中心由硅藻土壳体及其所带负电荷组成, 而负电荷会在硅藻土壳体表面形成一层负离子层(决定电位离子层);因异性电荷间的引力作用, 负离子层外围会形成一层正离子层(也称反离子层), 正负离子层发生相对位移时便形成电位差(即ζ电位).溶液pH值主要通过改变ζ电位影响硅藻土对Cu2+、Zn2+、Mn2+的吸附过程.由图 4b可知, 供试硅藻土等电点为2.00左右, 当pH值大于2.00时, 硅藻土颗粒表面才会表现出负电性, 随pH值的上升, 负电性逐步增强, 更利于吸附的进行, 硅藻土对Cu2+、Zn2+、Mn2+的吸附量也随之不断提高.当pH值不断下降并趋于等电点时, 大量的H+会与Cu2+、Zn2+、Mn2+竞争吸附点位, 使硅藻土壳体表面产生严重的质子化, 硅藻土颗粒负电性大幅下降, 吸附量严重下降.
3.1.4 溶液温度(T)的影响
在自然pH值, 离子初始浓度200 mg·L-1, 一定投加量的条件下, 恒温振荡2 h, 进行溶液温度对硅藻土吸附Cu2+、Zn2+、Mn2+的影响研究, 结果见图 5.从图中可以看出, 溶液温度的影响规律不明显, 总体趋势是吸附量随溶液温度的升高而先升高后下降.供试硅藻土对Cu2+、Zn2+、Mn2+的吸附量分别于溶液温度为45、45、55 ℃时达到最大值2.18、2.75、4.01 mg·g-1.由此可见, 最适温度范围为35~45℃, 过高或过低的温度都不利于吸附的进行, 这与以往研究不一致(Sameer and Fawzi, 2001;Jiang et al., 2006).
图 5溶液温度的影响
液/固吸附体系, 硅藻土对重金属离子的吸附分3步:① 离子首先由溶液经液膜扩散至硅藻土表面;② 再由表面向孔道内部扩散;③ 最后与活性基团发生吸附反应.因此, 溶液温度对吸附过程的影响表现在以下3个方面:① 溶液温度会影响离子运动速率, 升高温度可以加速离子运动, 增加离子与硅藻土表面接触的机会, 有利于吸附进行;② 当离子经液膜扩散至硅藻土表面后, 需要脱去自身水膜才能进入孔道发生吸附反应, 此过程为吸热过程, 温度升高有利于该过程的进行;③ 当离子进入孔道与活性基团发生的吸附反应为自发反应, ΔG<0, 离子在溶液中为三维运动, 进入吸附态后变为二维, 熵值减小, ΔS<0, 据热力学方程ΔH=ΔG+TΔS可知, ΔH<0, 由此可见最终的吸附反应是放热反应, 升温不利于吸附过程进行.由此看来, 溶液温度对硅藻土吸附重金属离子过程的影响是多方面的, 所以规律不明显, 但可以肯定的是温度过高或过低都不利于吸附的进行.
3.2 硅藻土对Cu2+、Zn2+、Mn2+吸附过程属性研究3.2.1 等温吸附属性
描述液/固体系吸附行为的常用等温吸附模型有Freundlich、Langmuir、Tenkin和D-R模型, 它们的线性表达式见表 2.根据以上模型对等温吸附试验数据进行分析拟合, 结果见表 3.
表 2 常见等温吸附模型线性表达式

表 3 各等温吸附模型线性相关分析及参数值
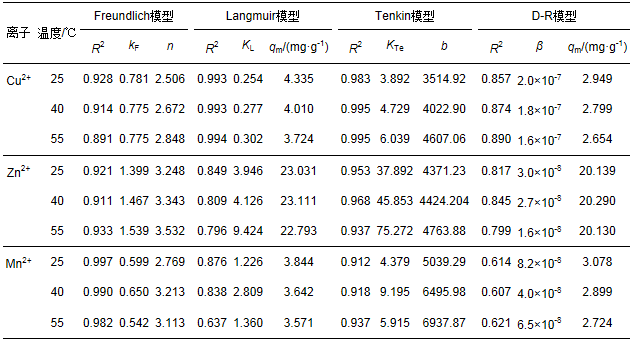
从表中可以看出, Freundlich、Langmuir、Tenkin、D-R 4种模型对不同温度下Cu2+吸附数据的拟合优度R2值范围分别为0.891~0.928、0.993~0.994、0.983~0.995和0.857~0.890;对Zn2+的R2值范围分别为0.911~0.933、0.796~0.849、0.937~0.968和0.799~0.845;对Mn2+的R2值范围分别为0.982~0.997、0.637~0.876、0.912~0.937和0.607~0.621.由此可见, 最适合描述供试硅藻土吸附Cu2+、Zn2+、Mn2+的模型分别为Langmuir、Tenkin和Freundlich.这与Safa等(2012)研究结果不一致, Safa等(2012)研究表明, 阿尔及利亚天然硅藻土对Cu2+、Zn2+等重金属离子的等温吸附过程既符合Langmuir模型也符合Freundlich模型, 说明不同产地的硅藻土对重金属离子的吸附特征存在较大差异, 在实际应用时应重视对硅藻土理化结构及吸附特性的分析.通过Langmuir的常数qm可知, 硅藻土对Cu2+、Zn2+、Mn2+的吸附容量(25 ℃时)理论值分别为4.335、23.031、3.844 mg·g-1.
3.2.2 吸附过程理化属性
根据前人研究(Chen et al., 2010;Nguyen, 2001), 可根据Freundlich吸附常数n值的大小确定吸附反应理化属性.一般认为, n>1, 吸附为物理过程;n<1, 吸附为化学过程;n=1, 吸附呈线性.可以通过Langmuir模型吸附常数kL来计算RL(RL=1/(1+kLC0)).以RL大小判定吸附反应难易程度, 一般认为:RL=0, 吸附过程不可逆;0 < RL < 1, 吸附容易进行;RL=1, 吸附呈线性;RL>1, 吸附很难进行.此外还可依据D-R模型活性系数β(mol2·J-2)计算吸附能量E(kJ·mol-1), 计算公式为E=1/(2β)1/2, 根据E值大小进一步确定吸附反应的理化属性.一般认为, E<8 kJ·mol-1, 吸附以物理作用为主;E在8~16 kJ·mol-1之间, 吸附以离子交换作用为主;E在20~40 kJ·mol-1之间, 吸附以化学作用为主.吸附过程属性参数计算结果见表 4.
表 4 各离子吸附属性判别参数值
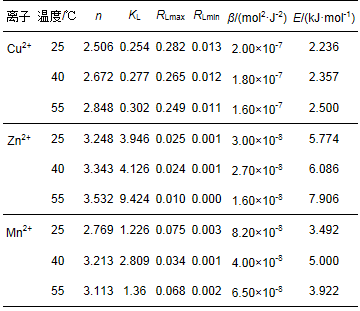
从表 4中可以看出, 当溶液温度在25~55 ℃发生变化时, 硅藻土吸附Cu2+、Zn2+、Mn2+的RL值的区间分别为0.011~0.282、0.000~0.025、0.001~0.075, 均在0~1之间, 表明Cu2+、Zn2+、Mn2+在硅藻土表面的吸附容易进行.各离子Freundlich吸附常数n值的区间分别为2.506~2.848、3.248~3.532、2.769~3.213, 均大于1, 表明Cu2+、Zn2+、Mn2+在硅藻土表面的吸附主要为物理过程, 即吸附反应主要依靠范德华力或库仑力的作用.各离子在硅藻土表面的吸附能量E值的区间分别为2.236~2.500、5.774~7.906、3.492~5.000 kJ·mol-1, 均小于8 kJ·mol-1, 也表明硅藻土对Cu2+、Zn2+、Mn2+的吸附主要为物理过程.
3.2.3 吸附过程控制步骤
动边界模型常被用于研究液/固体系离子在吸附剂表面吸附过程的控制步骤, Cu2+、Zn2+、Mn2+在硅藻土表面的吸附可分为3个过程(王春峰等, 2009;马红梅等, 2006;Hui et al., 2005):① Cu2+、Zn2+、Mn2+由液相经液膜扩散至硅藻土表面;② 再由硅藻土表面向孔道内部扩散;③ 最终为Cu2+、Zn2+、Mn2+与孔道内表面活性基团发生吸附反应.因此, Cu2+、Zn2+、Mn2+在硅藻土表面的吸附受到液膜扩散、颗粒扩散和吸附反应3个过程的影响, 速率最慢的步骤即为吸附过程的控制步骤.液膜扩散、颗粒扩散和化学反应方程线性表达式见式(2)~(4).
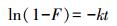
(2)
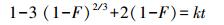
(3)

(4)
式中, F=qt/qe, 为t时刻的吸附分数;k为速率常数.采用上述方程对qt-t吸附数据进行了拟合, 拟合所得控制步骤速率常数k值见表 5.
表 5 离子吸附过程控制步骤速率常数k值(T=30 ℃)
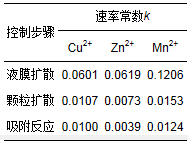
通过k值(表 5)可以判定, 供试硅藻土吸附Cu2+、Zn2+、Mn2+过程的控制步骤均为发生在孔道内离子与活性基团之间的吸附反应, 与硅藻土吸附Pb2+的过程类似(朱健等, 2012), 这对于实际应用具有重要指导意义.在应用硅藻土处理含重金属离子废水时, 因尽量使硅藻土颗粒与重金属离子混合均匀、充分接触, 以促进与加快孔道内的吸附反应, 缩短水力停留时间, 减少占地及能源的消耗.
3.2.4 吸附动力学属性
吸附时间对硅藻土吸附Cu2+、Zn2+、Mn2+的影响见图 6.从图中可以看出, 随着吸附时间的延长, 供试硅藻土对Cu2+、Zn2+、Mn2+的吸附量先是迅速升高, 而后分别于40、20、20 min时达到平衡, 平衡吸附量分别为2.62、7.80、3.96 mg·g-1.由此可见, 适当延长吸附时间, 有助于提高硅藻土吸附量, 一般在40 min以内基本可以达到吸附平衡, 此后继续延长吸附时间, 吸附量变化不大.
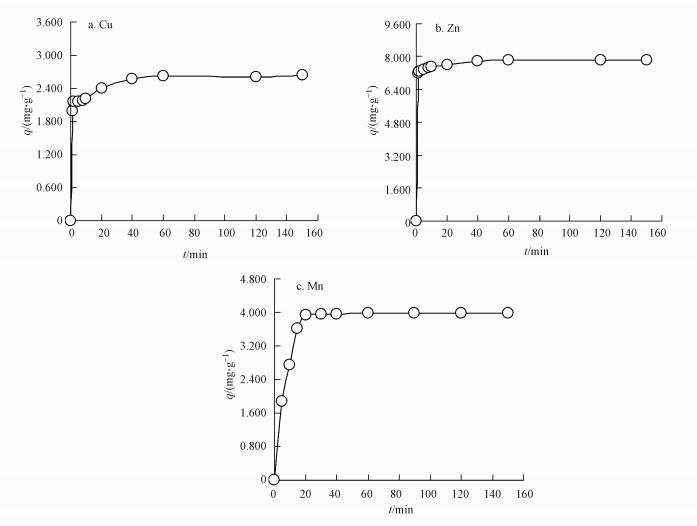
图 6吸附时间的影响
在应用硅藻土处理含重金属离子废水时, 为了保证出水水质, 往往需要考虑吸附量与吸附时间之间的关系.吸附时间的长短不仅会影响出水水质, 还涉及处理单元容积及占地等问题, 吸附动力学的研究可以为上述问题的解决提供一定的信息.采用一级动力学方程、二级动力学方程、Elovich方程和双常数方程对吸附时间的影响数据进行拟合, 结果见表 6.
表 6 不同动力学方程参数估计值(T=30 ℃)
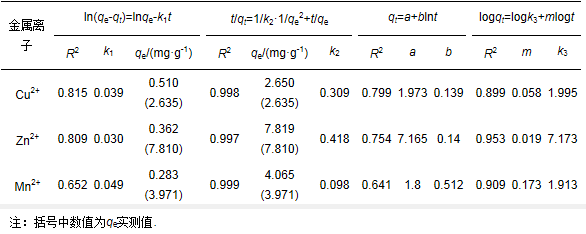
由表 6可知, 二级动力学方程拟合度最高, R2值均大于0.995, 表明供试硅藻土吸附Cu2+、Zn2+、Mn2+过程符合二级动力学, 拟合所得qe值与实测值非常接近, 与祝春水等(2015)、张伟丽等(2012)、Safa等(2012)研究结果一致, 说明吸附过程各步骤有着不同的反应速率, 这也充分验证了前述吸附过程控制步骤的研究结果.拟合优度相对较高的为双常数方程, R2值均大于0.895, 双常数方程通常用于描述粘土表面能量分布的非均质性, 说明随吸附反应的进行, 硅藻土表面饱和度增加, 被吸附离子间斥力增加, 因而整个体系能量随之增大.一级动力学和Elovich方程拟合R2值相对较低, 说明二者均不能很好地描述硅藻土吸附各离子的过程.根据一级动力学拟合结果也可获取qe, 但与实测值相差很大, 无实际意义. Elovich方程参数b值可以反映硅藻土吸附离子的速率, 但由于拟合优度差, b值无法反映吸附速率的真实情况.
3.2.5 吸附热力学属性
由前述研究可知, 溶液温度对Cu2+、Zn2+、Mn2+在硅藻土表面吸附的影响表现在多个方面, 而其中吸附过程热力学属性的影响最为重要.吸附热力学的研究主要是为了确定吸附过程的Gibbs自由能变(ΔG0, kJ·mol-1)、焓变(ΔH0, kJ·mol-1)和熵变(ΔS0, kJ·mol-1), 这些参数可通过Van't Hoff方程求取.
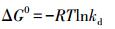
(5)
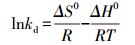
(6)
式中, R是热力学常数, 8.314 J·mol-1·K-1;T为绝对温度(K);kd为热力学平衡常数(L·g-1), 可通过ln (qe/Ce)对qe作图获取.吸附热力学研究结果见表 7.
表 7 不同温度下硅藻土吸附Cu2+、Zn2+、Mn2+的热力学参数
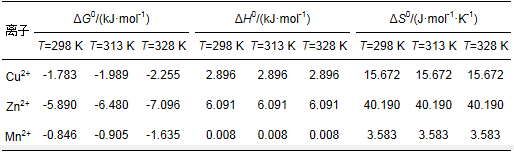
由表 7可知, ΔG0均小于0, 表明供试硅藻土吸附Cu2+、Zn2+、Mn2+过程均为自发过程.且随温度的升高, ΔG0降低, 自发性增强, 说明升温对整个吸附过程有利. ΔH0大于0, 表明硅藻土对各离子吸附过程是吸热的, 升温有利于吸附过程进行. ΔS0大于0, 说明整个吸附体系混乱程度增加, 这可能是因为吸附过程交换出了大量硅藻土本身携带的金属阳离子, 如K+、Na+、Ca2+、Mg2+等.这与已有的研究结果一致, 也与大部分重金属离子在硅藻土表面的吸附热力学特性相似.如Beheshti和Irani(2016)研究表明硅藻土纳米颗粒对Pb2+的吸附过程是自发的、吸热的. Safa等(2012)研究表明阿尔及利亚天然硅藻土对Cu2+、Zn2+、Cd2+和Pb2+吸附是容易的、自发的。
4 结论(Conclusions)
1) 硅藻土对Cu2+、Zn2+、Mn2+的吸附量, 随投加量的增加和离子初始浓度的增大而先增大后减小.投加量和离子初始浓度对硅藻土吸附Cu2+、Zn2+、Mn2+的影响均可归结为液/固比(液相离子与硅藻土的质量比)的影响, 过高或过低的液固比均不利于吸附, 硅藻土吸附Cu2+、Zn2+、Mn2+所需的最佳液/固比分别为0.025、0.100和0.100.
2) 硅藻土对Cu2+、Zn2+、Mn2+的吸附量, 随溶液初始pH值的上升而先轻微增大后趋于平衡最后大幅增加.溶液初始pH值与硅藻土等电点(2.0) 之间的关系决定了溶液初始pH值对硅藻土吸附Cu2+、Zn2+、Mn2+的影响, 接近或低于硅藻土等电点都不利于吸附, 过高的pH值会导致Cu2+、Zn2+、Mn2+发生沉淀.硅藻土吸附Cu2+、Zn2+、Mn2+所需的最适溶液初始pH值区间分别为4.0~6.0、4.0~7.0和4.0~7.0.
3) 溶液温度对吸附过程的影响规律不明显, 主要在于溶液温度对硅藻土吸附Cu2+、Zn2+、Mn2+的液膜扩散、颗粒扩散和吸附反应3个过程的影响不一致.
4) 最适于描述硅藻土对Cu2+、Zn2+、Mn2+的等温吸附模型分别为Langmuir、Tenkin、Freundlish模型;硅藻土对各离子的吸附过程以物理过程为主、容易进行;吸附过程控制步骤为孔道内的吸附反应.硅藻土对Cu2+、Zn2+、Mn2+的吸附在40 min内达到平衡, 二级动力学方程可以较好地描述硅藻土对各离子的吸附过程;硅藻土对Cu2+、Zn2+、Mn2+的吸附是自发的, 吸热的, 无序性增加。 |
