锌是我国重要的有色金属矿产之一,中国长期对锌资源的高强度开发,锌消费量显著增加,资源优势已逐渐弱化.美国、日本以及欧洲各国均十分重视从含锌废料中回收利用锌的研究,目前再生锌几乎占全球锌总产量的三成以上.我国再生锌产业起步晚,再生锌产业仍有很大的发展潜力.世界上锌的全部消费中约有一半用于镀锌,通常电镀含锌废水pH值约为4~5,废水中锌的浓度一般为25~800 mg · L-1,如何再生利用各种含锌的二次资源,实现电镀含锌废水的资源化具有十分重要的意义.
溶剂萃取法是一种低成本回收有色金属的有效技术,通过萃取和反萃取可得到富集浓缩的含锌溶液,有利于进一步回收利用金属锌.前期研究表明利用二壬基萘磺酸(简称DNNSA或HD)反胶团溶液萃取回收含锌电镀废水中的锌是可行的,通过萃取和反萃取可得到富集浓缩的含锌溶液,有利于进一步回收利用金属锌,实现无渣工艺,减少环境污染,且该方法易实现规模化和连续操作,易与其他分离技术相耦合;DNNSA无需皂化,且萃取过程中受水相pH影响较小,在酸性条件下仍能有效萃取酸性废水中的锌.
目前国内外反胶团萃取主要研究方向为提取生化物质,且工艺条件优化研究居多,将反胶团萃取应用于重金属废水资源化的研究较少.为了更深入了解DNNSA反胶团萃取锌的机理,进一步判定DNNSA反胶团溶液萃取锌的动力学特性,故对DNNSA反胶团溶液萃取电镀废水中锌的动力学进行了研究.
萃取过程动力学位于多相体系的物理化学、流体力学及两相间的质量传递的交叉处,恒界面池是应用最广泛的萃取动力学研究实验装置.恒界面池可通过调节两相搅拌速率消除扩散影响,在两相界面状态稳定的情况下,测定被萃物质浓度与时间的变化关系,得到萃取速率.根据萃取速率与搅拌速率、温度、萃取剂浓度、被萃物浓度的关系,便可确定萃取过程控制模式及萃取速率方程.恒界面池使用简单,易实现连续测定和自动控制,研究结果正确可靠.
本文采用恒界面池对DNNSA反胶团溶液萃取锌的动力学进行了研究,以确定该体系萃取锌的动力学控制类型,探讨DNNSA反胶团萃取锌的机理,为有效控制和强化萃取过程,设计萃取设备提供基础理论数据.
2 实验部分(Experimental section) 2.1 主要实验试剂和仪器
所用试剂主要有二壬基萘磺酸(苏州化工厂)、煤油(成都石油化工科技有限公司)、ZnSO4·7H2O(成都科龙化工厂)等,除二壬基萘磺酸和煤油外,其余均为分析纯.
实验仪器主要有赛曼火焰原子吸收分光光度计(GGX-6,北京海光仪器公司)、智能水份滴定仪(ZSD-2J,上海安亭仪器厂)、透射电镜(H-800,日本日立)、广角激光光散射仪(BI-200SM,美国布鲁克海文仪器公司).
2.2 实验装置和实验方法
自制恒界面池(图 1)装置的主要部件为一玻璃反应器,操作温度通过恒温槽控制.采用聚四氟乙烯制成的搅拌浆,转速可调.有机相和水相之间有界面环,两相接触界面积可通过选择不同直径的界面环进行调节.恒界面池中设有水相取样管,取样引起的体积变化小于3%.
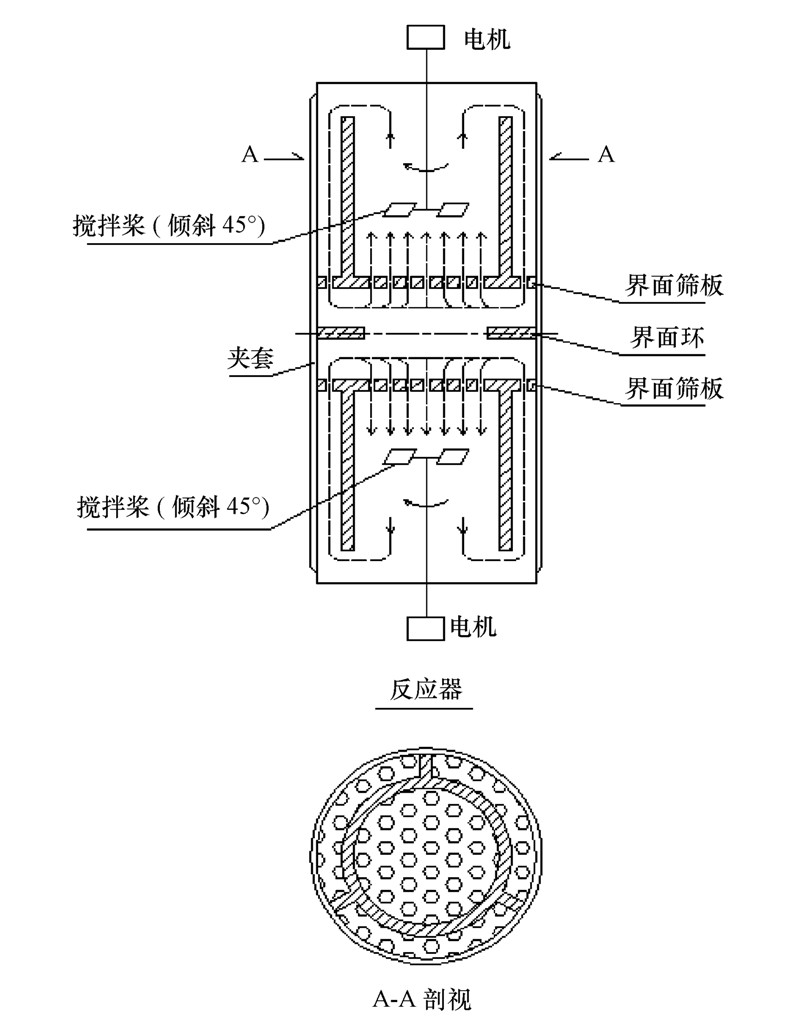
图 1 恒界面池结构简图
实验时,先将所需水相加入恒界面池恒温至所需温度,然后小心加入相同体积和温度的有机相,同时启动两相搅拌器,核定转速、计时.采用火焰原子吸收分光光度法测定分析不同时刻水相中Zn2+浓度(张嫦和胡蓉,1997),有机相中Zn2+浓度通过物料衡算求得.
2.3 实验数据处理
萃取速率反应萃取进行的快慢,一般用单位时间内被萃取物质浓度的变化来表示,实际萃取过程中,萃取时段一般在萃取初始阶段,此时金属离子浓度随时间变化呈线性关系,故本文主要研究萃取初始阶段的萃取动力学,此时金属锌离子浓度随时间变化呈线性关系,此直线斜率即为该萃取过程线性段的萃取速率R0(余静等,2014),表示为:
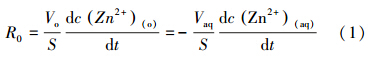
其中,R0为线性段萃取反应速率(mol · cm-2 · s-1);c(Zn2+)(o)为有机相锌离子浓度(mol · L-1);c(Zn2+)(aq)为水相锌离子浓度(mol · L-1).S为两相接触界面积(cm2);Vo为有机相体积(mL);Vaq为水相体积(mL).
3 结果与讨论(Results and discussion) 3.1 扩散阻力区的确定
考察3种不同搅拌条件对锌萃取速率的影响:仅有机相搅拌(200 r · min-1 / 0 r · min-1)、仅水相搅拌(0 r · min-1 / 200 r · min-1)和两相同时搅拌(200 r · min-1 / 200 r · min-1).
由图 2可见,仅有机相搅拌时,水相锌离子浓度随时间变化不明显,而仅水相搅拌和两相搅拌时水相锌离子浓度随时间而明显下降,且两者下降速率接近,这说明水相传质阻力远大于油相传质阻力,故可判断萃取反应不在有机相进行.萃取过程中由于带电荷的水合金属离子不可能存在于非极性的有机相主体中,金属离子的萃取反应都发生在界面及其附近的区域中,因此该萃取过程中萃合物生成反应只可能发生在水相一侧.

图 2 扩散阻力区的确定
3.2 两相搅拌速率对萃取速率的影响
搅拌速率分别为100、150、180、200、230 r · min-1,考察两相搅拌速率对锌萃取速率的影响.
萃取过程的控制类型包括扩散控制、化学反应控制或混合控制模式.当萃取速率随搅拌速率加快而不断增加时,萃取过程属于扩散控制;当搅拌速率继续增大,萃取速率出现一个与转速无关的区域(称为“坪区”),则可认为是化学反应控制.应用恒界面池研究萃取动力学时,搅拌速率对萃取速率的影响是判断动力学过程控制类型的重要依据之一.由图 3可见,当搅拌速率低于200 r · min-1时,萃取速率随搅拌速率的增加直线上升,此阶段属于扩散控制;当转速高于200 r · min-1后,萃取速率不再随之增加而急剧增加,进入“动力学坪区”,说明此时萃取过程属于化学反应控制.
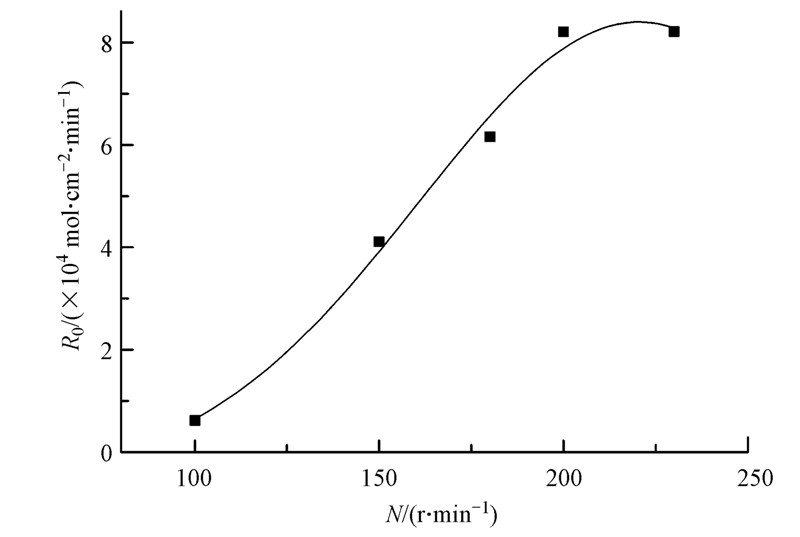
图 3 两相搅拌速率对萃取速率的影响
实验条件下,当转速N=200 r · min-1时,由搅拌雷诺数公式

可求得:有机相搅拌雷诺数为9067>1000,水相搅拌雷诺数为11366>1000,此时不但维持局部湍动状态,而且两相界面较为稳定,具有较高的传质效率.故以下实验搅拌速率均为200 r · min-1.
3.3 两相接触界面积对萃取速率的影响
分别改变两相接触界面积(S)为6.56、12.06、15.40、22.40 cm2,考察界面积对锌离子萃取速率的影响.从图 4可见,两相接触面积的改变对锌萃取速率的影响极小,这表明该萃取过程并非为界面化学反应控制,而是属于水相内化学反应控制过程.
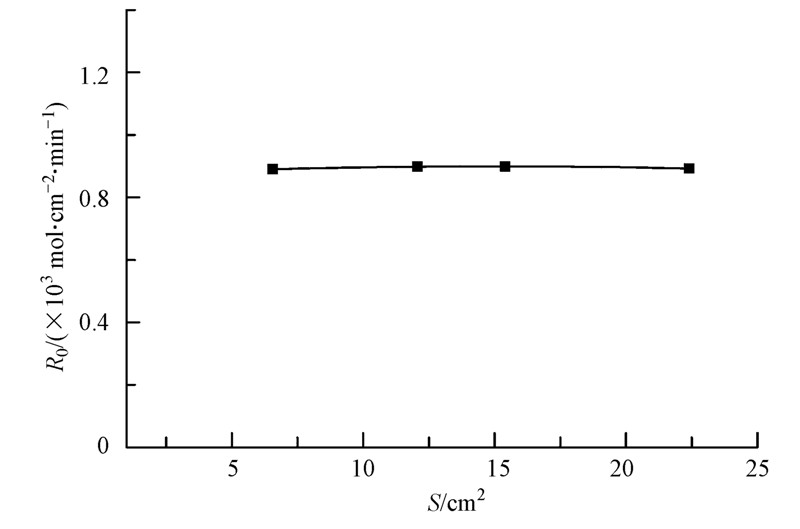
图 4 界面积对萃取速率的影响
3.4 宏观动力学方程的确定
实验条件下有机相中萃合物的浓度很低,萃取反应远离平衡,逆反应可忽略,金属萃取过程的动力学取决于反应区的反应物浓度.根据质量作用定律,萃取速率方程可写为:
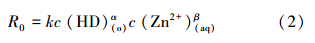
其中R0为萃取反应速率(mol · cm-2 · s-1);k为反应速率常数(cm4 · mol-1 · min-1);α、β为反应分级数;c(HD)(o)为有机相DNNSA浓度(mol · L-1);c(Zn2+)(aq)为水相锌离子浓度(mol · L-1).
用孤立变量法可求得α、β.实验结果如图 5和图 6所示,直线斜率即为α、β(刘彬和卢荣,2009).由图 5和图 6可分别得到α≈0.6343,β≈0.4246.将α≈0.6343,β≈0.4246,带入式(2)得到DNNSA反胶团溶液萃取废水中锌的宏观动力学方程:
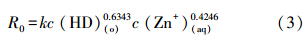
其中,R0为萃取反应速率(mol · cm-2 · s-1);k为反应速率常数(cm4 · mol-1 · min-1);c(HD)(o)为有机相DNNSA浓度(mol · L-1);c(Zn2+)(aq)为水相锌离子浓度(mol · L-1).

图 5 有机相HD浓度对萃取速率的影响

图 6 水相锌离子对萃取速率的影响
反应级数越大,则浓度对反应速率影响越大,上述实验结果表明锌离子浓度和萃取剂浓度在实验条件下对萃取反应速率影响较大.
由式(1)和(3)可得:
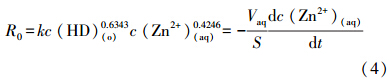
式中,R0为萃取反应速率(mol · cm-2 · s-1);k为反应速率常数(cm4 · mol-1 · min-1);c(HD)(o)为有机相DNNSA浓度(mol · L-1);c(Zn2+)(aq)为水相锌离子浓度(mol · L-1);S为两相接触界面积(cm2);Vaq为水相体积(mL).
实验条件下,由于DNNSA量大大超过水相中锌离子量,故整个实验过程中可视为萃取剂浓度不变,由式(4)可得

即

,积分得:

令

,则Δc=0.01755kt.萃取温度分别为298、303、308、313、318K时,考察温度对锌萃取速率的影响,作不同温度下Δc~Time关系图(图 7),直线斜率为0.01755k,求得不同温度下反应速率常数k;由阿累尼乌斯公式lnk=-Ea/(RT)+ lnA,作ln k与1/T关系图(图 8),由直线斜率可得表观活化能Ea=61.69 kJ · mol-1,由截距可求得指前因子A=4.039×108 cm4 · mol-1 · min-1.

图 7 Δc与时间的关系图
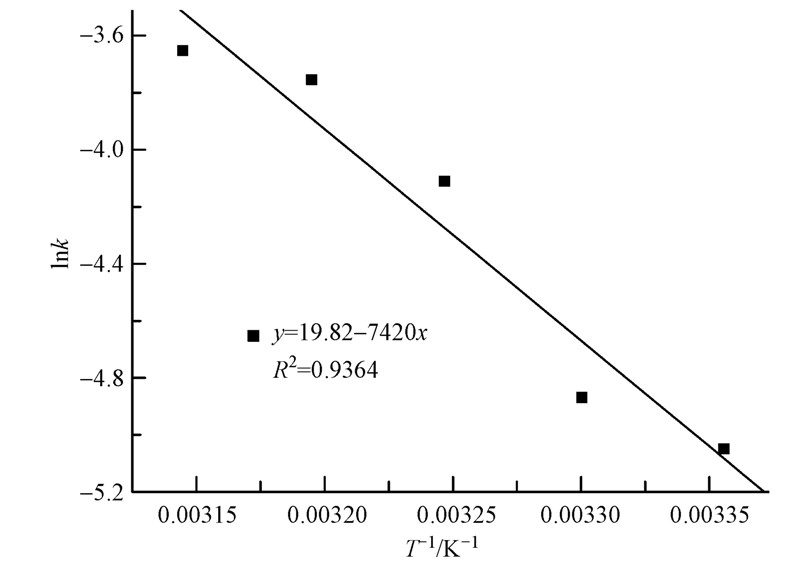
图 8 lnk与T-1 关系图
一般认为萃取反应活化能大于20.9 kJ · mol-1时,为化学反应控制(Yang et al., 2015),该萃取过程较大的表观活化能数据也证实过程为化学反应控制.DNNSA反胶团萃取酸性废水中锌离子的宏观萃取动力学方程为:

其中,R0为萃取反应速率(mol · cm-2 · s-1);c(HD)(o)为有机相DNNSA浓度(mol · L-1);c(Zn2+)(aq)为水相锌离子浓度(mol · L-1);T为萃取温度(K).
3.5 DNNSA反胶团萃取锌的机理初探
前已述及,在本实验条件下DNNSA反胶团萃取废水中锌离子的速率控制步骤为水相内化学反应,大多数萃取过程属于界面化学反应控制,且只有极少数属于相内反应或混合控制过程.
DNSNA为有机磺酸类萃取剂,具有两亲性,易于吸附在油水两相界面上,分子结构中极性较强的磺酸基在界面的水相一侧产生电离双电层;而DNNSA临界胶团浓度(CMC)为10-5,DNNSA 在煤油中的团聚数为8,作为萃取剂时常以反胶团形式存在.
虽然萃取剂DNNSA在界面上的富集使反应有利于界面上进行,但是界面上的分子的活度和反应活性又可能比主体溶液中低,同时由于DNNSA在水相中的溶解度、待萃取的水相中水合锌离子的稳定性以及萃合物生成的反应速度的影响,故使得萃取反应发生的区域有可能可从界面向水相内移动.该萃取动力学过程可能为:
(1)反胶团体系处于一种动力学平衡状态,相互之间不断碰撞且经常交换内核所含物质,这些交换通常发生在10-3s的时间范围内,而碰撞发生10-6s的时间范围内,反胶团间交换物质非常频繁.当反胶团与油水界面接触可能发生粘性碰撞,使得反胶团在界面处凹陷开孔(图 9).
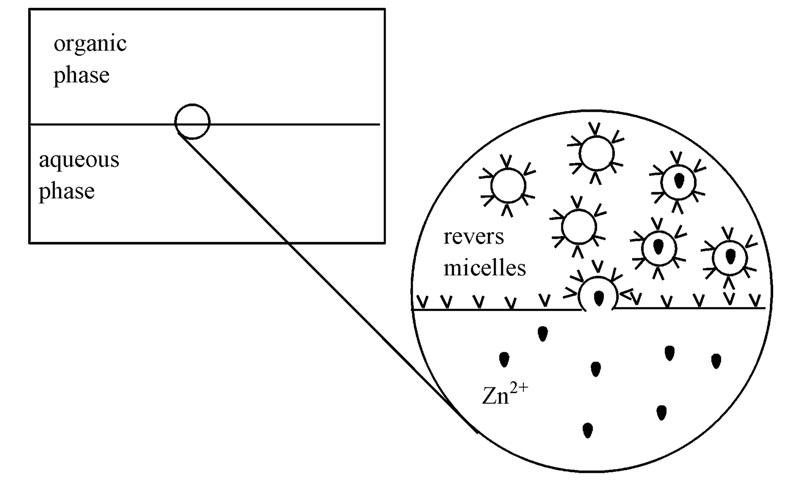
图 9 锌离子从水相到反胶团内水相的物质传递示意图
(2)在实验条件下,两相主体传质效率较高,由于反胶团在界面处凹陷,使得内水相和水相主体相连,水相主体的锌离子与DNNSA发生阳离子交换反应,此步骤为速率控制步骤,其反应速率与界面积大小无关,单位时间内降低的锌离子浓度即为该阳离子交换反应的反应速率:
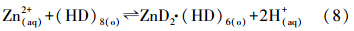
(3)负载的反胶团离开油水界面,扩散进入有机相主体.
前期研究结果亦证实,被萃取的锌离子确实不是靠溶解这种物理作用进入有机相,而是与反胶团发生阳离子交换形成磺酸盐,增溶进入了反胶团内水相.
为进一步验证上述推论,实验对萃取后负载金属的DNNSA反胶团溶液进行透射电镜(TEM)分析.图 10为负载金属离子的DNNSA反胶团溶液的透射电镜(TEM)表征结果.
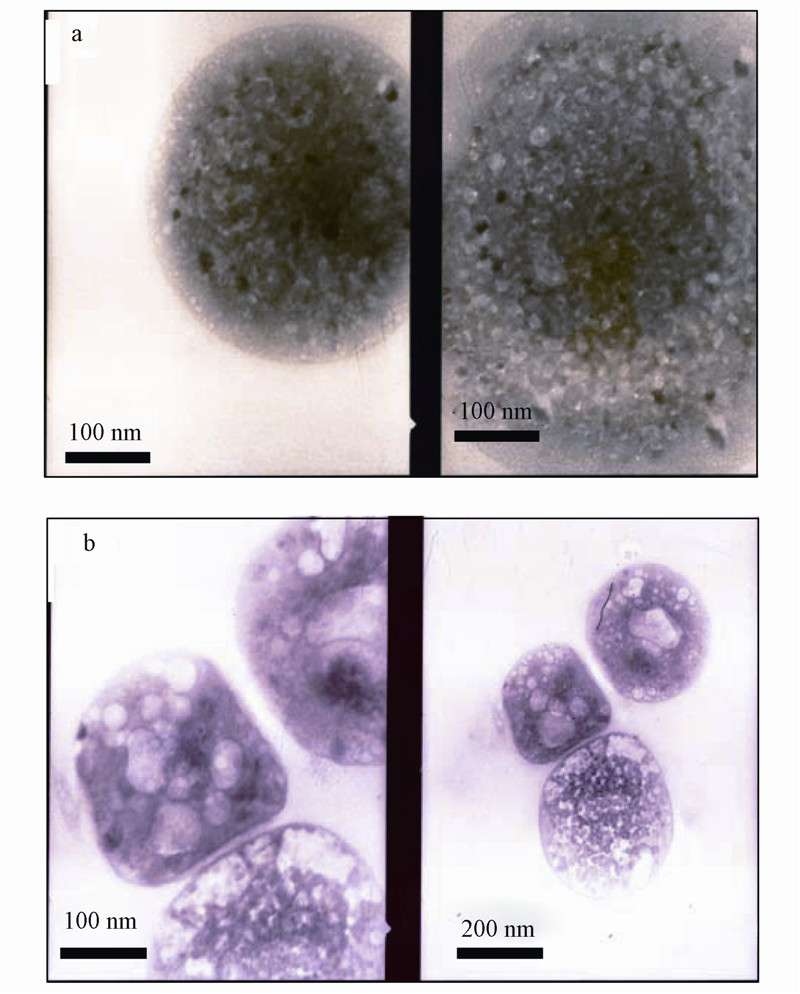
图 10 负载DNNSA反胶团TEM图
DNNSA反胶团具有热力学稳定结构,宏观上是水、煤油和DNNSA的均匀混合体,而在微观上是形成一种薄膜(即DNNSA的单分子膜),隔离开互不兼容的液体(即内水相和油相主体),形成次级相结构.而TEM可以提供高分辨率的影像和抓拍任何共存结构状态和微结构的过渡态,TEM已成为广泛使用的表征微乳相结构的直接工具.
图 10的TEM影像证实:DNNSA分子在煤油中聚集可自组装形成不同形状的反胶团(图 10 a和b),被萃取的金属离子确实进入反胶团的内水相(图 10 a中小黑点即为被萃取的金属离子);由图 10还可见,被萃金属离子所在内水相存在清晰的界面,这是由于DNNSA反胶团属于油包水(W/O)型微乳相,细小的水相颗粒分散于油相中,水相表面覆盖一层DNNSA单分子膜,分子的非极性端朝向油相,极性端朝向水相,故该W/O型微乳相可和多余油相共存.由图 10的TEM照片可估计,负载金属离子的反胶团大小约为200~400 nm.
通常,决定反胶团结构大小的一个重要参数是“水池”(内水相)中溶入的水与表面活性剂的摩尔浓度之比W0.根据实验所得宏观动力学方程可知,增加萃取剂DNNSA的浓度有利于萃取,但是如果反胶团形态不稳定,随着萃取剂浓度增加,胶团界面可能会被破坏,从而导致渗滤现象,导致萃取率下降,对萃取不利.因此对不同浓度的DNNSA煤油溶液萃取后的含水质量百分率(XH2O)进行测定(表 1).
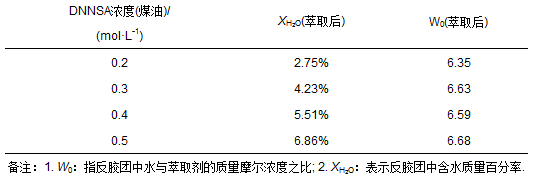
表 1 DNNSA浓度对反胶团含水量的影响
从表 1可以看出,不同浓度DNNSA反胶团萃取后,W0受DNNSA浓度的影响均很小,基本上为一常数.说明负载金属离子的DNNSA反胶团的粒径不随DNNSA浓度而变化,粒径基本保持不变,反胶团形态稳定.
为进一步验证,采用BI-200SM广角激光光散射仪对负载金属的0.5 mol · L-1 DNNSA反胶团溶液的粒径进行了测定(表 2),测试结果表明萃取后DNNSA反胶团粒径约为357.4 nm,该结论也与上述TEM实验结果相吻合.
| STOPPED |
- |
A CR(avg.) |
168 kcps |
| |
| Elapsed Time |
00:02:00 |
Eff Dia |
357.4nm |
| Base Diff |
0.133% |
Poly |
0.128 |
注: 1. Elapsed Time:定义测量时间; 2. A CR(avg.):平均光强,CR指content rate,计数率,为光强的单位;kcps指kilo content per second; 3. Base Diff:极限差异,通常Base Diff <1%的时候,测量均是可信的; 4. Eff Dia:有效粒径,这是一个等效值,不是平均值;可以用有效粒径来表征所测体系; 5. Poly:多分散性,表明样品的分散情况,一般Poly<0.1是一个窄分布,Poly>0.2是一个宽分布.
表 2 0.5 mol · L-1 DNNSA溶液萃取后粒径的自相关测试报告
虽然增加DNNSA浓度有利于萃取,但是随着有机相浓度增加,萃取后有机相粘度增大,分相将需要较长的时间,故实际过程应综合考虑实验条件和萃取效果等因素.
4 结论(Conclusions)
1)随着反胶团溶液浓度增加,反胶团形态稳定,DNNSA反胶团萃取废水中锌离子的速率控制步骤为水相内化学反应,要加快萃取速率可采取增加萃取剂浓度、金属离子浓度、升温等措施.
2)DNNSA反胶团溶液萃取废水中锌离子的宏观动力学方程为:
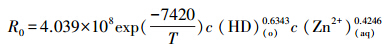 |
